【Cell重磅成果】SLC7A11 是溶酶体中的非常规 H+ 转运蛋白
2025-05-12
2025年4月24日,浙江大学科研团队在顶级刊物《Cell》上,接连发表两项重磅科研成果,引发社会讨论,关注度非常高。今天小编将和大家分享其中一篇由基础医学院徐浩新教授团队发表的文章“SLC7A11 is an unconventional H+ transporter in lysosomes”。该研究首次揭示了SLC7A11(xCT)作为溶酶体膜上的非常规H+转运体,通过调控胱氨酸(cystine)和谷氨酸(glutamate)的跨膜流动介导溶酶体质子泄漏。这一发现不仅挑战了传统认知中SLC7A11仅作为质膜胱氨酸/谷氨酸逆向转运体的功能定位,更为溶酶体pH稳态调控、铁死亡(ferroptosis)及神经退行性疾病机制提供了全新视角。

一、研究背景
溶酶体保持 4.5–5.0 的酸性 pH 值,最适合大分子降解。同时,溶酶体 pH 的正常化可以去除这些神经退行性疾病中的有毒蛋白质聚集体,这意味着溶酶体 H+ 通量途径可能在溶酶体功能和细胞健康的调节中发挥关键作用。而溶酶体酸化不当与多种神经病理有关,包括帕金森病 (PD) 和阿尔茨海默病 (AD)。溶酶体酸度是其降解能力的主要决定因素,在单个溶酶体中,管腔 pH 值受到动态调节,以平衡质子流入和跨溶酶体膜的外排途径。V 型 ATP 酶 (V-ATP 酶) 主要负责溶酶体质子内流。TMEM175是溶酶体中质子激活的 H+ 选择性通道,当溶酶体 pH 值 (pHLy) 低于 4.5 时,它充当快速 H+ 泄漏途径 (LysoH1)。但是由于内源性 LysoH1/TMEM175 在弱酸性条件下无活性,当溶酶体的 pHLy 为 4.5∼6.0 时,需要一个未知途径来实现 H+ 泄漏。
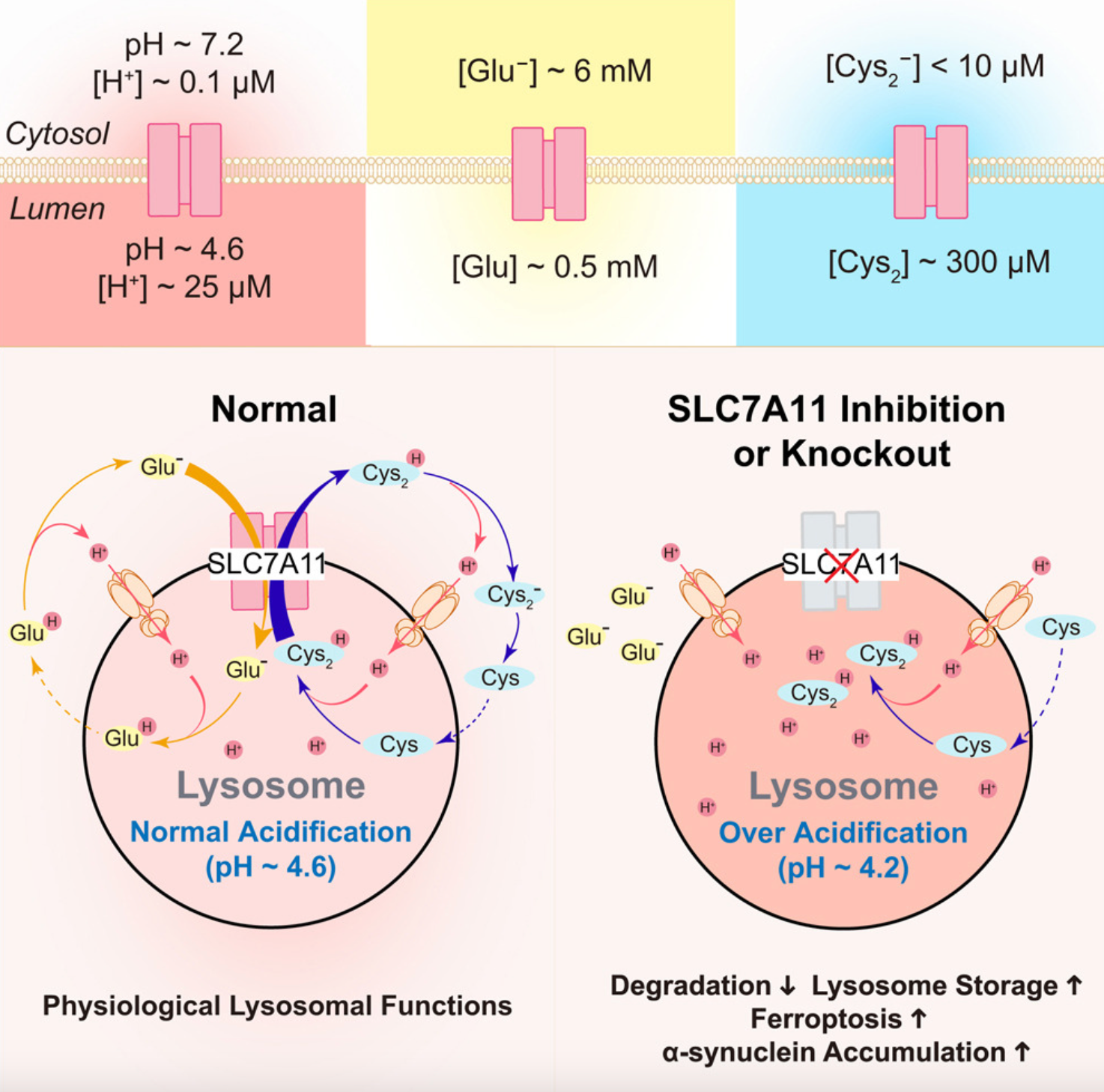

图1:研究概览图
核心结论:
1.溶酶体 SLC7A11 通过胱氨酸和谷氨酸通量介导缓慢的 H+ 泄漏;
2.SLC7A11 缺陷会导致溶酶体过度酸化和降解减少;
3.溶酶体 pH 稳态是防止 erastin 诱导的铁死亡所必需的;
4.SLC7A11 功能障碍促进神经元中的病理性 α-突触核蛋白聚集。
二、研究结果
1.SLC7A11蛋白的新功能
为了探究这一通量途径,研究团队构建了孤儿溶酶体膜蛋白(OLMP)敲除细胞系文库,并从中筛选出去酸化的关键蛋白SLC7A11。接着通过小分子化合物库高通量筛选实验找到了对溶酶体酸性有显著增强的小分子Erastin, 它是SLC7A11抑制剂。据此,SLC7A11 被确定为 LysoH2 通路的分子介质。其作为一种非传统的质子转运体发挥作用,通过介导胱氨酸和谷氨酸的跨膜流动,实现溶酶体质子的缓慢外泄,从而维持溶酶体的酸性环境。
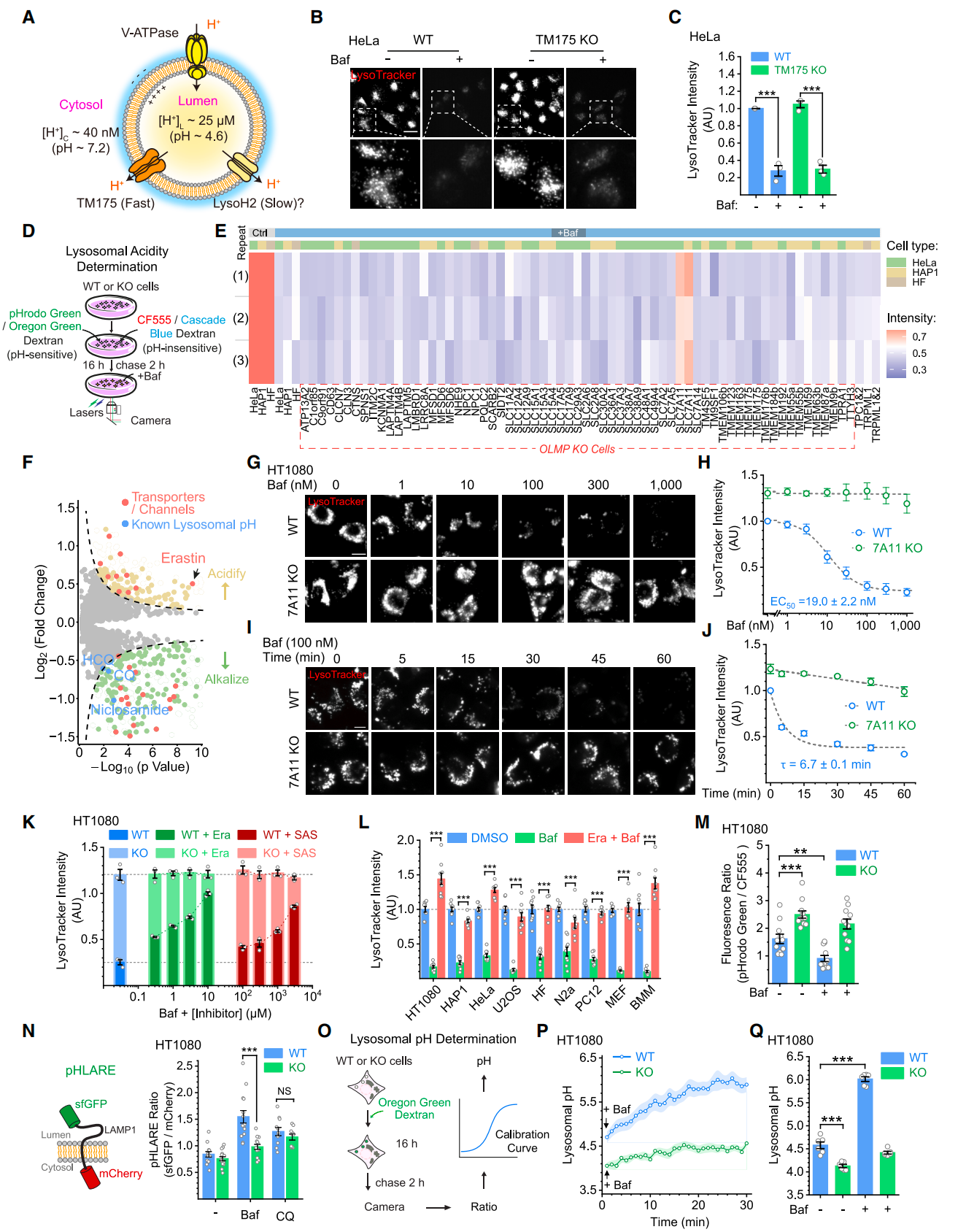
图2:鉴定 SLC7A11 是细胞溶酶体 H+ 泄漏的必要分子
2.SLC7A11与溶酶体功能的调控
内源性 SLC7A11 蛋白富集于从 WT HT1080 细胞免疫沉淀的溶酶体组分中,但在 SLC7A11 KO 细胞的溶酶体中不存在。研究团队通过实验证明SLC7A11 是一种溶酶体膜蛋白。
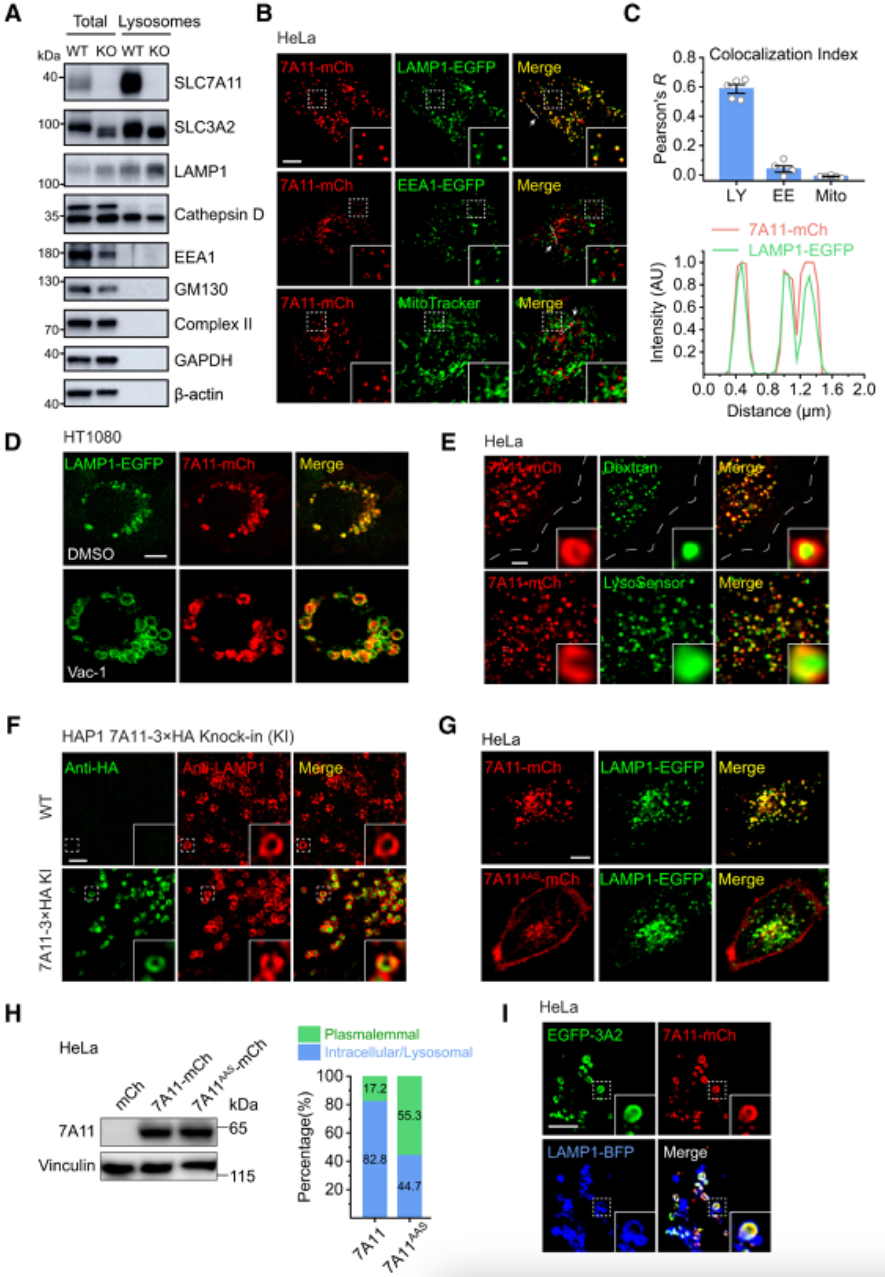
图3:SLC7A11 是一种溶酶体膜蛋白
溶酶体与铁死亡有关,溶酶体 H + 泄漏的缺陷可能导致多步骤铁死亡过程中的关键事件。虽然TMEM175 (LysoH1) 和 SLC7A11 (LysoH2) 都调节溶 酶体 pH 值。但是,铁死亡是由 SLC7A11 缺乏引起的。SLC7A11 是铁死亡的关键调节因子,其缺失或抑制会导致溶酶体过度酸化,进而降低降解效率、积累储存物质,并促进细胞铁死亡(ferroptosis)。此外,SLC7A11还通过调控溶酶体的酸性环境,影响α-突触核蛋白的聚集,这在帕金森病的发病过程中起着关键作用。
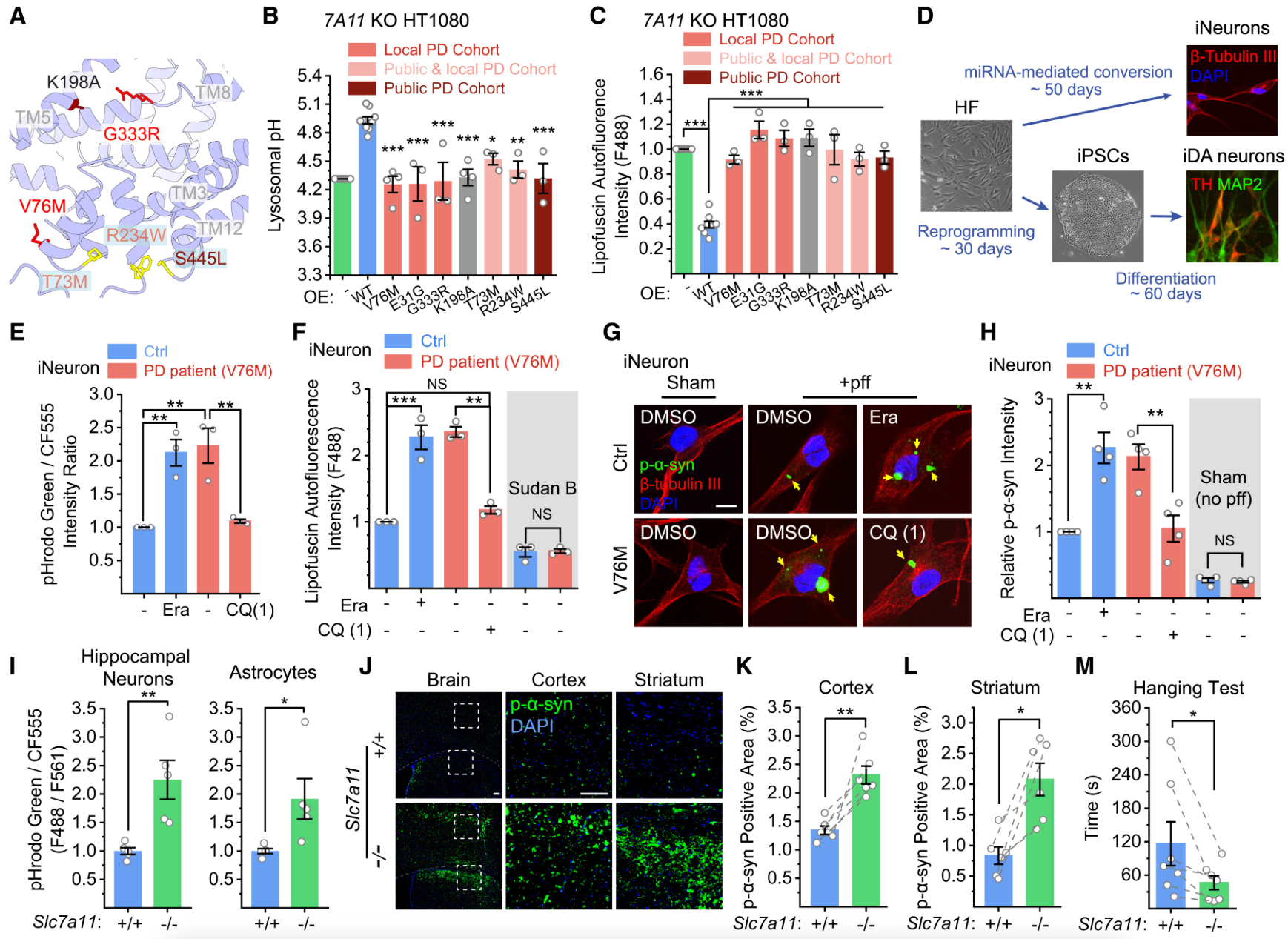
图4:溶酶体 SLC7A11 介导影响溶酶体功能、铁死亡和 PD 样病理的 AA-通量依赖性 H+ 耗散
三、 SLC7A11的科研价值与转化潜力
1. 膜蛋白功能研究
SLC7A11作为12次跨膜的溶酶体-质膜双定位蛋白,其转运功能直接关联铁死亡、氧化应激、免疫代谢等热点领域,易于串联基础机制与转化研究。利用SLC7A11构建的细胞模型(如基因敲除、荧光报告系统等)可用于筛选调节膜蛋白稳定性、转运活性或蛋白互作的化合物,推动高通量药物筛选技术发展。
2. 疾病发生与药物靶点研究
SLC7A11是一种氨基酸转运蛋白,在人类恶性肿瘤中经常过度表达。SLC7A11 的表达和活性受肿瘤细胞中的癌基因和抑癌基因通过多种机制精细调控,对胱氨酸和谷氨酸具有高度特异性。胱氨酸在肿瘤微环境(TME)中主要由SLC7A11进行细胞内转运,参与GSH合成,导致肿瘤细胞铁死亡抵抗,促进肿瘤发生和发展。此外,越来越多的研究表明,SLC7A11与心血管系统疾病的发生、发展密切相关,SLC7A11表达下调是阿托伐他汀诱发心肌细胞铁死亡的机制之一,为改进阿托伐他汀应用策略提供了新的靶点。
多项研究证实,靶向SLC7A11可以逆转恶性肿瘤治疗过程中的耐药性。根据Pharmsnap数据显示,已有1款靶向SLC7A11抗体在研临床药物(Anti-xCT antibody-drug conjugate (Agilvax))处于临床前阶段,用于肿瘤治疗。因此,SLC7A11抑制剂可以与临床一线化疗药物进行联合使用,此外,SLC7A11广泛分布于多种恶性肿瘤中,在恶性肿瘤代谢调控中的作用提示,SLC7A11可作为肿瘤治疗的潜在靶点。
四、 研究瓶颈及解决方法
SLC7A11在溶酶体与质膜的双重定位导致功能难以区分,且其在不同pH、氧化还原状态下的构象变化难以捕捉,膜蛋白的表达量低。此外,SLC7A11突变体的病理效应涉及多层级调控,病理模型的可靠构建及转化工具的靶向性还待优化。针对SLC7A11研究的核心痛点,无细胞蛋白表达系统显示出独特的价值:快速获得高活性蛋白用于药物发现、构建人工溶酶体模型解析病理机制、个性化医疗中的突变体功能验证等。这一技术将直接加速SLC7A11从基础研究到临床转化的全链条创新,为癌症、帕金森病等重大疾病的精准治疗开辟新路径。
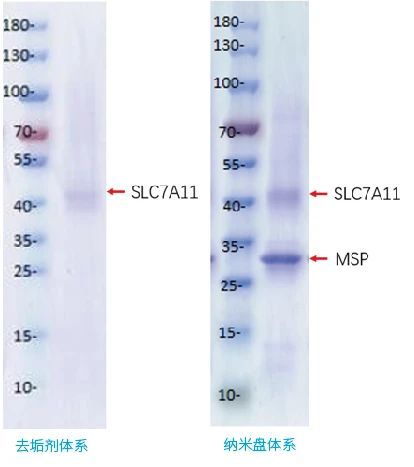
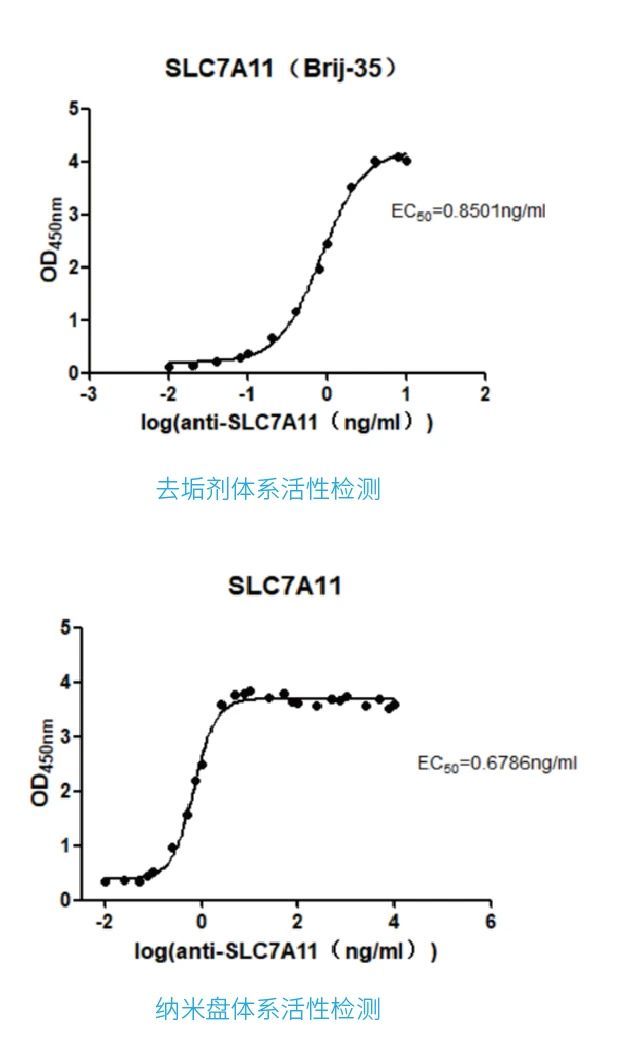
365英国上市(集团)有限公司-官方网站,利用无细胞技术,在去垢剂和纳米盘双平台下,成功表达纯化SLC7A11膜蛋白,并进行活性验证,取得较好结果。详情请见官网。
相关推荐
直播预告|7月9日周三18:00无细胞蛋白表达技术:从攻克难表达蛋白到打造跨膜蛋白爆款!
2025-07-04
2025-07-04
PLD新品 | 全长4次跨膜 Claudin-18.1——解码肺癌免疫微环境的关键钥匙!
2025-07-04
校园行 | 365英国上市官方网站无细胞技术走进上海交大转化医学院、江南大学
2025-07-04








